顶部
顶部
美国FDA批准的第三种旨在清除淀粉样蛋白的阿尔茨海默病药物;是首个且唯一有证据支持在清除淀粉样蛋白斑块后可停药的疗法。
【适应症】
本品是一种淀粉样蛋白 β 靶向抗体,适用于阿尔茨海默病的治疗。使用本品治疗的患者应处在轻度认知障碍或轻度痴呆阶段,且已确认患者存在淀粉样蛋白 β 病理。
【推荐剂量】
在启动本品治疗前,需要确认患者存在淀粉样蛋白 β 病理。
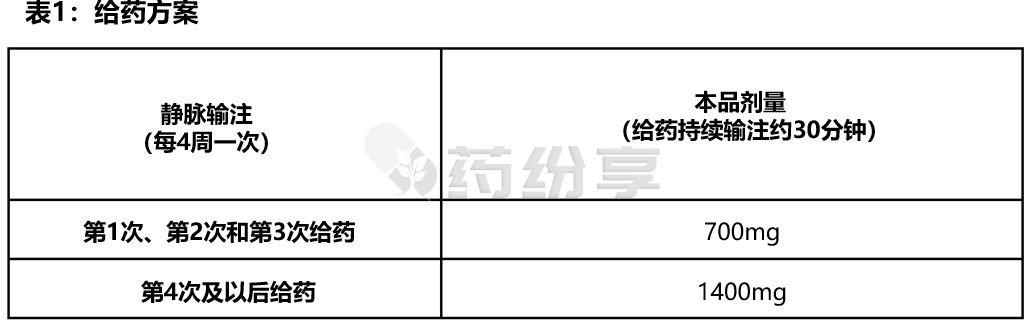
-初始前三次剂量:每次700mg,静脉输注,每次持续输注30分钟,每4周一次;
-后续剂量:每次1400mg,静脉输注,每次持续输注30分钟,每4周一次。(见表1)
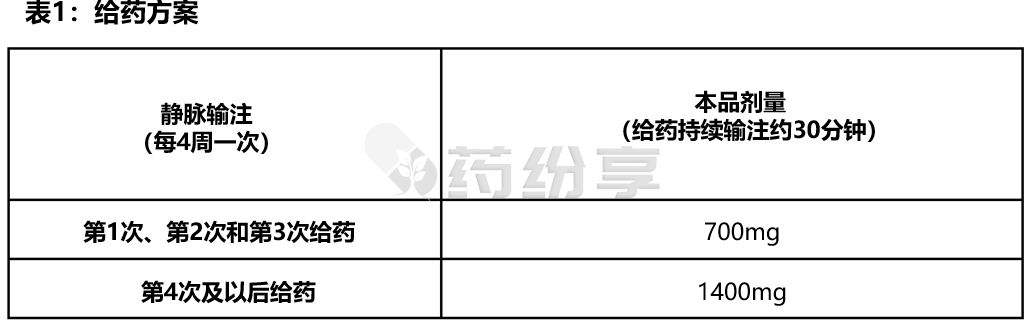
根据临床试验Study1,根据患者的PET图像,如果淀粉样蛋白水平降低到预定义阈值,则停药。
【不良反应】
最常见的不良反应(≥10% ):淀粉样蛋白相关影像学异常 -水肿 (ARIA-E)、ARIA-H 微出血、ARIA-H浅表性铁质沉着症和头痛。
【药理作用】
本品是一种人源化免疫球蛋白γ1(IgG1)单克隆抗体,针对不溶性N端截短的焦谷氨酸淀粉样β蛋白。大脑中淀粉样β蛋白斑块的积聚是阿尔茨海默病病的一个明确的病理生理学特征。本品可以减少淀粉样β斑块。
【贮藏】
未开封的小瓶在2°C至8°C冷藏储存。将药瓶放在外箱中避光保存。不要冻结或摇晃。如果无法冷藏,可在室温(20°C至25°C)储存3天。
【有效期】
24个月
【使用方法】
-本品仅供静脉输注,每次持续输注30分钟。
-在本品启动治疗前,需获取患者的最近基线脑部核磁共振(MRI)成像。在第2次、第3次、第4次和第7次给药前,获取患者的MRI成像。
-给药前,需要用 0.9%氯化钠注射液稀释本品至最终浓度为 4 mg/mL 至 10 mg/mL的溶液(见表4)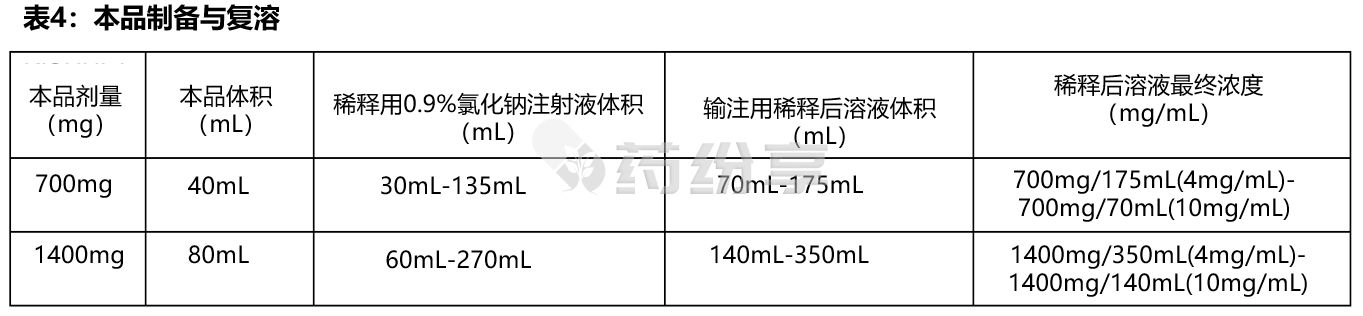
【推荐剂量】
在启动本品治疗前,需要确认患者存在淀粉样蛋白 β 病理。
-初始前三次剂量:每次700mg,静脉输注,每次持续输注30分钟,每4周一次;
-后续剂量:每次1400mg,静脉输注,每次持续输注30分钟,每4周一次。(见表1)
根据临床试验Study1,根据患者的PET图像,如果淀粉样蛋白水平降低到预定义阈值,则停药。
【剂量调整】
淀粉样蛋白相关成像异常的监测和给药中断。
本品可引起淀粉样蛋白相关影像学异常 -水肿 (ARIA-E) 和含铁血黄素沉积 (ARIA-H)。
-监测患者的ARIA:
在本品启动治疗前,需获取患者的最近基线脑部核磁共振(MRI)成像。在第2次、第3次、第4次和第7次给药前,获取患者的MRI成像。如果患者出现疑似ARIA的症状,应立即进行临床评估,包括MRI检查。
-ARIA患者中断给药的建议:
1)ARIA-E
ARIA-E 患者中断给药的建议见表2: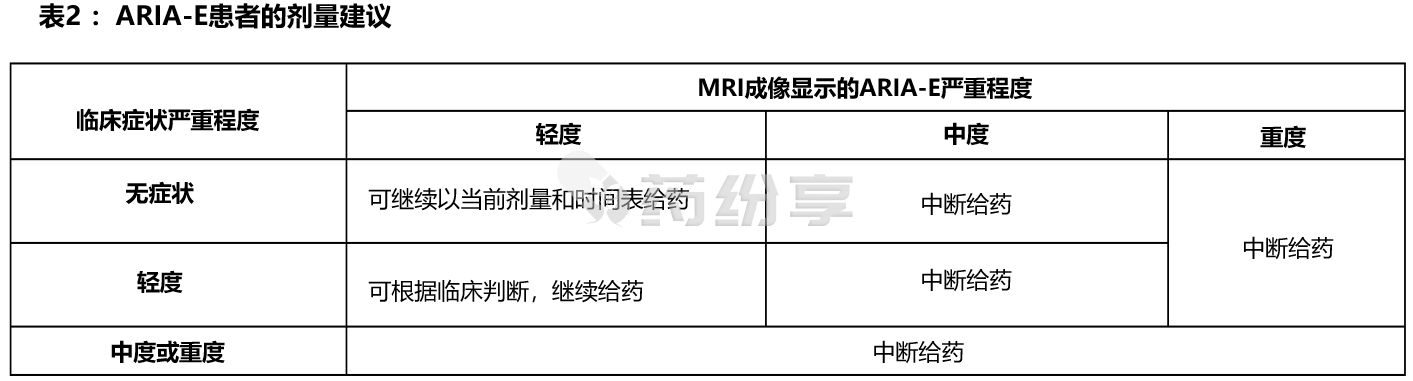
2)ARIA-H
ARIA-E 患者中断给药的建议见表3: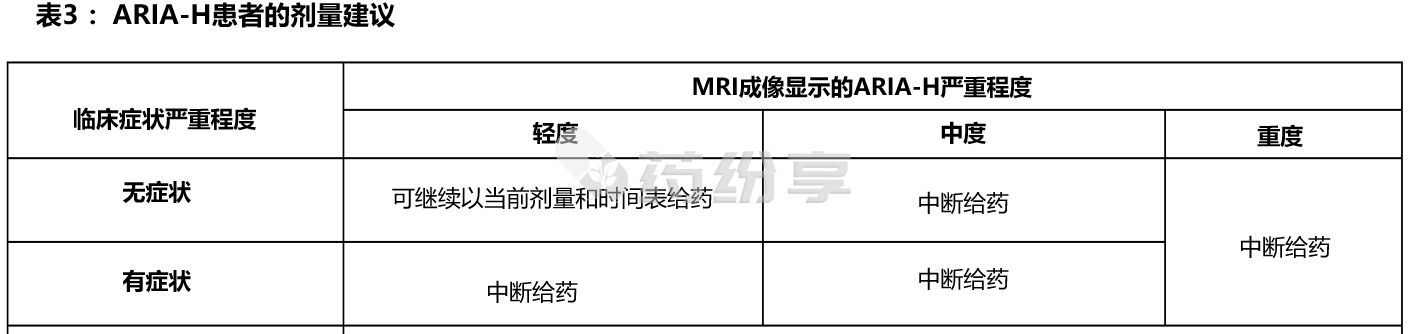
在本品治疗期间,对于发生直径大于1cm的脑出血的患者,需暂停给药直至MRI影像学显示稳定且症状(如果存在)消退。应以临床判断为指导,恢复给药。
【服用过量处理】
无
【漏服处理】
如果错过一剂输注,尽快以相同剂量每4周恢复给药。
【不良反应】
最常见的不良反应(≥10% ):淀粉样蛋白相关影像学异常 -水肿 (ARIA-E)、ARIA-H 微出血、ARIA-H浅表性铁质沉着症和头痛。
【注意事项】
-淀粉样蛋白相关影像学异常 (ARIA):
在本品治疗前24周内,建议增强临床警惕ARIA 。与杂合子和非携带者相比,在载脂蛋白 E ε4 (ApoE ε4)纯合子患者中,ARIA 的风险,包括有症状的ARIA 增加。治疗前有微出血和/或浅表铁沉着症的患者,在本品治疗期间,ARIA-E 和 ARIA-H的风险增加。然后患者出现疑似ARIA 的症状,根据指征,应进行临床评估,包括 MRI 扫描。
-输液相关反应:
如果患者出现输液相关反应,可能需要降低输液速率可或停止给药,并根据临床指征,开始适当的治疗。在后续给药前,应考虑使用抗组胺药、对乙酰氨基酚或皮质类固醇进行预处理。
【禁忌】
已知对本品t或本品任何辅料严重过敏的患者,禁用本品。
【特殊人群】
-怀孕:
尚无关于孕妇使用本品的足够数据来评估药物相关的重大出生缺陷、流产或其他不利的母亲或胎儿结局的风险。尚未进行动物研究来评估本品的潜在生殖或发育毒性。
-哺乳期:
没有关于母乳中分泌本品、对母乳喂养婴儿的影响或该药物对泌乳量的影响的数据。其他单克隆抗体的公布数据通常表明,单克隆抗体进入母乳的通过率较低,母乳喂养的婴儿全身暴露有限。这种有限暴露的影响是未知的。
-儿童:
尚未确定本品在儿科患者中的安全性和有效性。
-老年人:
在研究1中,暴露于本品的患者年龄范围为59至86岁,平均年龄为73岁;90%为65岁及以上,41%为75岁及以上。未观察到65岁患者与老年和年轻成年患者之间在本品的安全性或有效性方面存在总体差异。
【适应症】
本品是一种淀粉样蛋白 β 靶向抗体,适用于阿尔茨海默病的治疗。使用本品治疗的患者应处在轻度认知障碍或轻度痴呆阶段,且已确认患者存在淀粉样蛋白 β 病理。
【药物相互作用】
无相关信息。